Kannabisz és gyógyszerkölcsönhatások
 CBD-Gyógyszerkölcsönhatások: A Citokróm P450 Szerepe
CBD-Gyógyszerkölcsönhatások: A Citokróm P450 Szerepe
Elegendő dózisban a CBD átmenetileg deaktiválja a citokróm P450 enzimeket, ezáltal megváltoztatja sok vegyület metabolizálását.
Mivel a kannabidiol (CBD) hamarosan széles körben elérhető lesz gyógyszerekben, gyógytápanyagokban és növényi készítményekben, a kutatók egy közelebbi pillantást vetnek a CBD-gyógyszerkölcsönhatásokra.
A kannabidiol egy biztonságos, nem-bódító és függőséget nem okozó kannabisz vegyület ,jelentős terápiás tulajdonságokkal, de a CBD-gyógyszerkölcsönhatások bizonyos esetekben problémásak lehetnek.
A CBD és más növényi kannabinoidok potenciálisan kölcsönhatásba lépnek sok gyógyszerrel az által, hogy gátolják a citokróm P450 aktivitását, ami a májenzimek egy családja. Ez a kulcsenzim csoport bontja le a legtöbb gyógyszert amit fogyasztunk, köztük a kereskedelmi forgalomban lévő gyógyszerek több mint 60 százalékát.
A megfelelő adagban a CBD átmenetileg kikapcsolja a citokróm P450 enzimeket (3A, 2C és 2B alcsaládok), megváltoztatva azt, hogy hogyan bontunk le sokféle vegyület, beleértve a tetrahidrokannabinolt (THC), ami a kannabisz pszichotróp hatásáért felelős.

Amit a CBD gyógyszerkölcsönhatásokról tudni kell, röviden:
A THC lebontása
Amikor THC vagy bármely más idegen vegyület bejut a szervezetbe, azt a szervezet lebontja. Ez a folyamat általában nagyon bonyolult. Egy vegyület megfelelő lebomlása több molekuláris folyamatoton és különböző enzimekek keresztül történhet, amelyek lehetővé teszik a szervezetnek, hogy megszabaduljon a vegyülettől (ez gyakran valamilyan más vegyület hozzáadásával történik az eredeti vegyülethez). Vagy az anyagcsere azzal is járhat, hogy a vegyület egy sokkal egyszerűbb molekulára bomlik le, amit a szervezet aztán felhasznál.
Egy gyógyszer lebomlásának termékeit metabolitoknak (anyagcseretermékeknek) nevezzük. Ezek a metabolitok a kiindulási gyógyszertől rendkívül eltérő tulajdonságokkal rendelkezhetnek. Az etanol például egyes hatásait, beleértve a másnaposságot, annak kétlépéses anyagcseréjének köszönheti. Az etanol először acetaldehidá, majd ecetsavvá alakul és ez az acetaldehid az egyik fő oka az etanol májra kifejtett mérgező hatásának, valamint a hányingernek és a hányásnak, amit a túlzott fogyasztása okoz.
A THC metabolitjai jelentősen hozzájárulnak a kannabisz fogyasztás hatásaihoz. A 11-hidroxi-THC (11-OH-THC) például egy THC metabolit, amely aktiválja a CB1 kannabinoid receptort az agyban és erősebb pszichotróp hatást okoz, mint maga a THC. Ez azt jelenti, hogy a THC lebontása hatásosabbá teheti azt.
A citokróm P450 enzimek hozzájárulnak a gyógyszerek lebontásához azzal, hogy oxidálják őket, ami általában azt jelenti, hogy beépítenek egy oxigénatomot a gyógyszer molekuláris szerkezetébe. Az oxidáció általában vízoldhatóbbá tesz egy vegyületet és ezért könnyebb a veséknek kiszűrni. Az etanol lebontásának fennt említett mindkét lépése, és a THC átalakítása 11-OH-THC-vá egyaránt oxidáció bevonásával történnek (bár az etanolt nem kifejezetten a citokróm P450 oxidálja).
A kannabinoid bevitel különböző útvonalainak különböző hatásaik vannak. Az inhalált THC a kapillárisba jut a tüdőben, az általános keringésen keresztül átjut a pulmonális artériákon, és gyorsan átjut a vér-agy gáton. Azonban amikor szájon át vesszük be, a THC a vékonybélben szívódik fel, majd bekerül a májba, ahol a citokróm P450 altípusai (rövidítve CYP) bontják le, konkrétan a CYP2C és CYP3A enzimek.
Ezek a májenzimek bontják le a CBD-t is, majd átalakítják 7-OH-CBD-vé és 6-OH-CBD-vé. Azonban eddig viszonylag kevés kutatás készült ezeknek a CBD metabolitoknak a tulajdonságairól.
A kannabisz-használóknak több érzéstelenítésre lehet szükségük a műtétekhez
A CBD lebontása
Az, ahogy a CBD kölcsönhatásba lép a citokróm P450-el döntő fontosságú; lényegében kikapcsolják egymást. Preklinikai kutatások azt mutatják, hogy a CBD-t a citokróm P450 enzimek (CYP3A, 2C és 2B) bontják le, ezzel az azonos májenzimek “versenyképes gátlójaként” működik. Az enzimatikus aktivitás helyének elfoglalásával a CBD kiszorítja a kémiai versenytársakat és megakadályozza a citokróm P450-t, hogy más vegyületeket bontson le.
Az, hogy a kannabidiol milyen mértékben viselkedik a citokróm P450 versenyképes gátlójaként attól függ, hogy a CBD milyen szorosan kötődik a lebontó enzim aktív helyén az oxidáció előtt és után. Ez nagyon változó lehet, attól függően, hogy hogyan és mennyi CBD-t adagolunk, milyenek a gyógyszert szedő beteg egyéni tulajdonságai, és attól, hogy izolált CBD-t vagy egy teljes növényi gyógyszert használunk.
Ha a CBD dózis elég alacsony, nem lesz jelentős hatása a CYP enzimek aktivitására, azonban a CBD okozhat egyéb hatásokat is. Nincs egyértelműen megállapítható dózis, amely alatt a CBD nem lép kölcsönhatásba más gyógyszerekkel. Egy 2013 klinikai vizsgálat amelyben a GW Pharmaceutical által gyártott Sativexet használaták, ami egy teljes növényi, CBD-dús nyelv alatti sprayt, nem talált kölcsönhatásokat a CYP enzimekkel, amikor körülbelül 40 mg CBD-t adagoltak. Egy ezt követő klinikai vizsgálat azonban megállapította, hogy a 25 mg orálisan beadott CBD jelentősen blokkolja egy anti-epileptikus gyógyszer lebomlását.
A CBD terminális felezési ideje emberekben 18-32 óra.
A CBD eliminációja többfázisú; a terminális eliminációs felezési idő 750 és 1500 mg CBD után naponta kétszer körülbelül 60 óra volt; és a tényleges felezési idő 10 és 17 óra között változott.
Milyen hatással vannak a CBD által a citokróm P450 aktivitásban okozott változások a THC lebomlására? Állatkísérletek azt mutatják, hogy a CBD előkezelés növeli az agy THC szintjét. Ennek oka, hogy a CBD, ami a citokróm P450 versenyképes gátoljaként működik, lassítja a THC egy erősebb hatású metabolittá, a 11-OH-THC-vé való átalakulását. Következésképpen, a THC hosszabb ideig marad aktív, de a kiterjesztett pszichotróp hatás csúcsa kissé tompul a CBD hatása alatt.
Ezek mellett egyéb tényezők is szerepetet játszanak abban, hogy a CBD csökkenti, vagy semlegesíti a THC pszichotróp hatását.
Forrás: http://www.current-oncology.com/index.php/oncology/article/view/3487/2325
A CBD a következő CYP-450 enzimeket gátolhatja: 3A4, 2C19, 1A1, 1A2, 1B1, 2A6, 2B6, 2C9, 2C11, 2D6, 3A5, 3A7, 17
CBD gyógyszerkölcsönhatások
Kannabidiol–antiepileptikumok összehasonlítása és interakciója kísérletileg indukált rohamok esetében patkányokban. (1977)
http://www.ncbi.nlm.nih.gov/pubmed/850145
CBD és epilepszia ellenes gyógyszerek interakciója – Friedman et al.
Epidiolex® (CBD gyógyszerkivonat – GW Pharma) és antiepileptikumok interakciója:
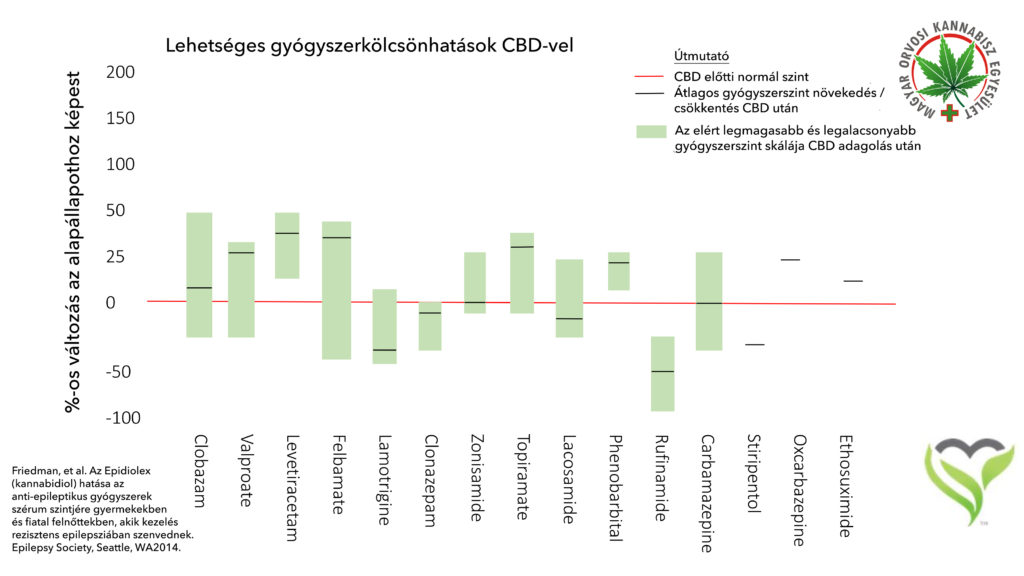
CÉL: Egy kiterjesztett vizsgálatban a kannabidiolt (CBD) vizsgálati új gyógyszerként (IND) tanumányozták, mint lehetséges adjuváns kezelést terápiarezisztens gyermekkori epilepsziában. A 25 vizsgálatban résztvevőből 13 kapott klobazám (CLB) kezelést. Mivel a CLB és a CBD egyaránt a citokróm P450 (CYP) útvonalon metabolizálódik, ebben a cikkben a várható gyógyszer-gyógyszer kölcsönhatást értékeljük.
MÓDSZER: Olyan tizenhárom terápirezisztens epilepsziás alanyt vontunk be a vizsgálatba IND 119.876 alatt, akik egyidejűleg szednek CLB-t és a CBD-t. A demográfiai adatokat begyűjtöttünk minden egyes alanynál, beleértve a kort, a nemet és a görcsrohamok etiológiáját, valamint egyidejűleg alkalmazott antiepilepsziás gyógyszerek (AED-k). A CLB, N-desmethylclobazam (norclobazam; NCLB), és a CBD-szinteket mértünk a CBD kezelés során. A CLB adagokat feljegyeztük az induláskor és a CBD kezelés 4. valamint a 8. hetén. A mellékhatások megfigyeltük.
EREDMÉNYEK: Emelkedett CLB és nCLB szinteket jelentettünk ezeknél az alanyoknál. Az átlagos (± szórás [SD]) CLB szint növekedés 60 ± 80% (95%-os konfidencia intervallum (CI) [-2-91%] a 4. héten); a nCLB szint átlagos növekedése 500 ± 300% volt (95% konfidencia intervallum (CI) [+90-610%], a 4 héten). A 13-ból 9 alany esetében volt > 50%-os csökkenés a rohamokban, ami megfelel a reagálók 70%-ának. A CLB és nCLB szintek növekedése és rohamok gyakoriságának csökkenése bekövetkezett, annak ellenére, hogy a CBD kezelés során a CLB adagot a 13-ból 10 (77%) alany esetében csökkentettük. A 13-ból 10 (77%) alany jelentett mellékhatásokat, de azok enyhültek a CLB dózis csökkentésével.
JELENTŐSÉG: A CLB és a nCLB szintek monitorozása szükséges az olyan klinikai betegellátásban, ahol a betegek egyidejűleg kapnak CLB-t és CBD-t. Mindazonáltal CBD egy biztonságos és hatékony kezelés olyan terápiarezisztens epilepsziás betegeknél, akik CLB kezelést kapnak.
A teljes kutatás az adagolás részleteivel itt olvasható:
Drug-interaction-between-clobazam-and-CBD-in-children-2015
CBD és klobazám kezelés összehasonlítása epilepsziára – retrospektív vizsgálat
2016-ban készült kutatás kifejezetten gyógyszerkölcsönhatásokat vizsgáló kutatás készült felnőtt és gyermek epilepsziás betegekkel Alabama államban.
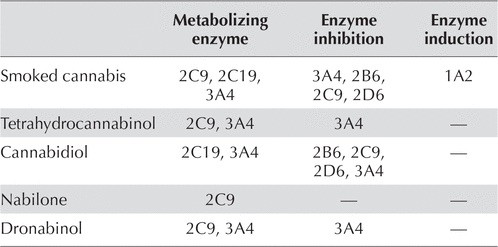
GYÓGYSZERKÖLCSÖNHATÁSOK A GYÓGYSZERÉSZETI MINŐSÉGŰ KANNABIDIOL (CBD) OLAJ ÉS A GYAKRAN HASZNÁLT ANTI-EPILEPTIKUS GYÓGYSZEREK (AEDk) KÖZÖTT
Módszer: Rugalmas CBD dózismódosítási ütemtervetet használtak 5 mg/kg/nap adaggal kezdetben, és a toleranciaszint, valamint a rohamkontroll szint eléréséig kéthetente 5 mg/kg/nap adaggal növelték, legfeljebb 50 mg/kg/nap adagig. A kiindulási AED szinteket a kritériumok részeként ellenőrizték. Az AED-eknek a vizsgálatra való jelentkezést megelőző 1 hónapig stabil dózisban kellett lenniük. Az AED-szinteket szinte minden vizsgálati látogatás során mértük az adag titrálása és fenntartása során. Az AED dózist a kutatók mérlegelésével állították be, ha kedvezőtlen hatást, a laboratóriumi rendellenességet vagy a gyógyszer szintjének emelkedését vagy csökkenését látták a CBD és a szóban forgó AED közötti lehetséges kölcsönhatással összefüggésben. Különösen a klobazám és a valproát dózisokat módosították gyakran a szedáció és a májfunkciós vizsgálatok változása miatt. Az elemzés idején 81 beteget vettek fel a vizsgálatba (39 felnőtt, 42 gyermek). A vizsgálati alanyok által használt AED-ok közül elegendő adatpont állt rendelkezésre a CBD és 19 AED közötti potenciális kölcsönhatások elemzésére (1. táblázat). Az adatokat Kevert Eljárással elemeztük annak megállapítására, hogy szignifikáns változás történt-e az egyes szérum AED-szintekben, ahogy a CBD dózisát növeltük. Az elemzést az összes alany és az egyes gyermekek és felnőtt csoportok között végeztük (ha az alkalmazható volt).
Következtetések: Jelentős gyógyszerkölcsönhatásokat azonosítottak a CBD és a klobazám (Onfi, Frisium), a rufinamid (Banzel, Inovelon), a topiramiát (Topamax), a zoniszamid (Zonegran) és az eslicarbazepin (Zebinix) között. Ez a tanulmány hangsúlyozza az AED szintek monitorozásának fontosságát a CBD kezelés alatt. A jövőben ezeket az adatokat összefüggésbe kell hozni a jelentett mellékhatásokkal és/vagy a laboratóriumi eltérésekkel annak meghatározása érdekében, hogy klinikailag jelentősek-e.
A teljes kutatás az adagolás részleteivel itt olvasható:
Interactions between cannabidiol and commonly used antiepileptic drugs – Gaston
FRISSÍTÉS 2016
Jelenlegi terápiás kannabisz-ellentmondások és a klinikai vizsgálatok tervezési problémái – Ethan Russo
“Mind a THC, mind a CBD a citokróm P450 rendszeren keresztül metabolizálódik. A GW Pharmaceuticals által végzett in vitro és in vivo állatokon végzett kísérletekben a gátló hatás csak a humán klinikai vizsgálatokban alkalmazott legnagyobb dózis-ekvivalenseknél szignifikánsan magasabb mennyiségnél volt megfigyelhető, és a citokróm P450 enzimek nem mutattak ki releváns indukciót in vitro humán CYP1A2, CYP2C9, CYP2C19 és CYP3A4 esetén. A gyógyszer-kölcsönhatás specifikus vizsgálatát humán alanyokban nabiximols-szal (Sativex®) végezték (Stott et al., 2013), és nem mutatkoztak klinikailag jelentős változások a CBD és a THC szintekben a ketokonazol, a rifampicin vagy az omeprazol együttes alkalmazásával. A kiterjedt klinikai alkalmazás során, beleértve komplex gyógyszeres kezeléseket opioidokkal, triciklikus antidepresszánsokkal, antikonvulzív szerekkel stb., nem figyeltek meg olyan gyógyszer-gyógyszer kölcsönhatásokat, amelyek ellenjavallják vagy kizárják a nabiximols használatát bármilyen specifikus gyógyszer alkalmazása esetén, bár additív (összeadódó) nyugtató hatások mindig lehetségesek (lásd részletesen Russo, 2006b). A nabiximolsban ezek a nyugtató hatásokat a CBD láthatóan ellensúlyozza (Nicholson et al., 2004).
A CBD indukálhatja a CYP2B izozimeket, és a CBD (Epidiolex®) jelenlegi megfigyelési és klinikai vizsgálatok során kezelhetetlen epilepszia esetén nagyon nagy dózisokban 25 mg/kg/nap-ig, az antikonvulzáns klobazám metabolitja az N-dezmetil klobazám szintje növekedést mutatott, aminek eredményeképpen szedálás lépett fel, ami anélkül reagált a gyógyszer dóziscsökkentésére, hogy ennek megfelelően csökkent volna az antikonvulzív hatás (Devinsky et al., 2016). Egyéb benzodiazepinek és valproinsav használata esetán óvatosságra van szükség.”
FRISSÍTÉS 2018
Gyakorlati megfontolások az orvosi kannabisz beadásában és adagolásában – Ethan Russo
A legtöbb gyógyszerkölcsönhatás más központi idegrendszeri depresszánsok és a kannabisz egyidejű alkalmazásához köthető. A klinikailag szignifikánsnak bizonyult gyógyszerkölcsönhatások ritkák és nincs olyan gyógyszer, amelyet ne lehetne a kannabisszal együtt alkalmazni, ha szükséges. A THC-t a 2C9, 2C19 és 3A4 (CYP) oxidálja. Ezért a szérumszinteket növekedhetik az inhibitorok, vagy csökkenthetik az enzimindukátorok. Kevés gyógyszerkölcsönhatás-vizsgálat készült. A meglévő vizsgálatok nem mutattak ki toxicitást vagy a kísérő gyógyszerek hatásvesztését, de elméletileg lehetséges. Az egyik kivétel a klobazám magas dózisú CBD-vél történő alkalmazása, ahol a nyugtató hatású metabolit, az N-dezmetil-klobazám magas szintje az adott gyógyszer adagjának csökkentését igényli.
Frissítés 2019
CES1 enzim
A növényi kannabinoidok és a karboxilészteráz 1 (CES1) nevű gyógyszer-metabolizáló enzim kölcsönhatásai a közelmúltban jelentek meg a Drug Metabolism and Distribution folyóiratban. A Michigani és Floridai Egyetem kutatói kimutatták, hogy a THC, a CBD és a kannabinol (CBN) mindegyike gátolja a CES1-et. A CES1 fontos a vérnyomást szabályozó gyógyszerek aktiválásához vagy inaktiválásához, valamint az ADD kezelésére felírt Ritalin gyógyszeréhez. A kannabinoidok csak nagy koncentrációban gátolják a CES1-et, de a nagy dózisú CBD-vel való kölcsönhatás problémás lehet. A nagy dózisú CBD (több száz vagy ezer miligramm) néha szükséges lehet, különösen akkor, ha a CBD-t izolátumként használják. E tanulmány szerint a THC és a CBN hatékonyabban gátolják a CES1-t, mint a CBD, de azokat általában sokkal kisebb dózisokban alkalmazzák. Így valószínűtlen, hogy a THC vagy a CBN problémás kölcsönhatásokat okozhat a CES1 enzimmell, bár a THC valószínűleg gátolja a CES1-t, amikor a krónikus kannabisz-használók a pszichotróp hatás csúcsához érnek. Megvizsgálták a THC metabolitjait is, de nem befolyásolták erősen a CES1-et. Végül volt némi bizonyíték arra, hogy ha a THC-t vagy a CBN-t fél órával a többi gyógyszer előtt használták, az nagyobb interakcióhoz vezetett, mint amikor mindkettőt egyszerre használták, de úgy tűnik a CBD esetében nem ez volt a helyzet. (Ez lehet a kísérleti módszer miatt, vagy utalhat a gátlás mechanizmusára.) Van egy jelentős kérdés, amit a kutatók nem válaszoltak meg: Mi a helyzet a krónikus kannabiszfogyasztással? A test gyakran alkalmazkodik az általa ismert szerekhez; ha a CBD gátolja a CES1 enzimet, lehetséges, hogy a máj több ilyen enzimet termel, hogy visszaállítsa az egyensúlyt. Jelenleg nincs adat ennek a kérdésnek a megválaszolásához. A kannabinoid-gyógyszer kölcsönhatások lehetőségét nem szabad a kannabisszal kapcsolatos félelmek generálására használni, de kiemeli a gyógyszerek egy másik csoportját, amelyet nagy dózisú CBD alkalmazásakor monitorzni kell.
Frissítés 2020
A Penns State Orvostudományi Főiskola kutatói közzétették azoknak a vényköteles gyógyszereknek a listáját, amelyeknél előfordulhat, hogy nem működnek megfelelően, ha az emberek orvosi kannabinoidok, CBD olaj, orvosi vagy rekreációs kannabisz mellett használják őket.
A kutatók olyan kannabinoid gyógyszereket vizsgáltak, amelyek befolyásolhatják azt, hogy a test mennyire gyorsan bont le egy vényköteles gyógyszert, vagy amelyek ugyanazon enzimért versenyeznek. Kiértékeltek négy kannabinoid gyógyszert, amelyek között voltak csak CBD-t tartalmazó, valamint THC-tartalmú termékek (dronabinol, nabilone, CBD és nabiximols).
Szűk terápiás indexű gyógyszerek, amiket fokozottan felügyelni kell, amikor kannabinoidokkal együtt alkalmazzák. (Kattintás ide a listáért.)
A kannabinoid-gyógyszerkölcsönhatásokkal kapcsolatos kutatások legfrissebb összesítése. (Kattintás ide.)
Ha valaki úgy dönt, hogy a szedett gyógyszerek mellett CBD olajat használ, akkor ajánlott az esetleges kölcsönhatás elkerülése vagy minimalizálása érdekében a CBD olajat NEM a gyógyszerekkel egy időben, mindig a gyógyszerek UTÁN és nem előtte, a lehető legnagyobb (akár több órás) különbséggel alkalmazni.
A CBD és a takrolimusz kölcsönhatása
A takrolimusz egy immunszupresszív gyógyszer, amit főleg transzplantációban az átültetett szerv kilökődésének megelőzésére, illetve kezelésére használnak.
Klinikailag jelentős gyógyszer-kölcsönhatás bizonyítása a kannabidiol és a takrolimusz között.
Egyre több a bizonyíték arra, hogy CBD-t a CYP3A4 és a CYP2C19 metabolizálja, ami arra utal, hogy ezeket az enzimeket hatékonyan gátolja. Először jelentjünk egy jelentős gyógyszer-gyógyszer kölcsönhatást egy tisztított CBD termék és a takrolimusz között. Egy epilepsziás klinikai vizsgálat résztvevőjénél, aki takrolimuszt is kapott, körülbelül 3-szorosára növelte a normalizált takrolimusz koncentrációját a 2000-2900 mg/nap CBD használata. Jelentésünk a transzplantációs közösség számára fontos figyelmeztetést jelent a kannabisz növekvő legalizálásával és az FDA által jóváhagyott CBD termék megjelenésével. Nagyobb vizsgálatok szükségesek ahhoz, hogy jobban megértsük a gyógyszer-gyógyszer kölcsönhatás hatását a szilárd szervátültetésben részesülőknél.
A CBD növelheti az everolimusz vérkoncentrációját
Egy egészséges emberekkel végzett vizsgálatban, ahol az alanyok az everolimusz immunszuppresszív gyógyszert kapták, 12,5 mg CBD/testtömeg-kilogramm dózis jelentősen növelte az everolimusz vérkoncentrációját. A szerzők megjegyezték, hogy „az everolimusz vérkoncentrációjának monitorozása erősen javasolt megfelelő dóziscsökkentéssel, ha CBD-vel együtt adják”.
Grépfrút és kannabisz
Lester Bornheim a University of California kutató farmakológusa San Franciscoban, egyike volt az első tudósoknak, aki tanulmányozta CBD lebomlását. 1987-ben elnyerte a NIDA (Nemzeti Drogabúzus-ellenes Intézet) támogatását, hogy megvizsgálja a fitokannabinoidok citokróm P450 enzimekre kifejtett hatását. THC és a kannabinol (CBN) is gátolja a CYP aktivitását, de az összes vizsgált növényi kannabinoid közül a CBD gátolja a legerősebben a citokróm P450 enzimeket.
“Ez egy nagyon szokatlan enzim. Szinte minden más enzim úgy van tervezve, hogy egyetlen hordozó illeszkedjenek bele és egyetlen kémiai folyamatot végezzenek el, aminek következtében egyetlen végtermék keletkezik,” jegyezte meg Bornheimben, miközben a citokróm P450 számos gyógyszer lebontását végzi, valamint úgy tűnik, hogy sokféle más exogén és endogén anyagot is ezek az enzimek bontanak le.
1999-ben Bornheim a Nemzetközi Kannabinoid Kutató Társaság (ICRS) éves találkozóján felhívta a figyelmet arra a lehetőségre, hogy a CBD sok gyógyszer lebomlását befolyásolhatja. Egy évvel korábban egy csapat kanadai tudós azonosított bizonyos grépfrút vegyületeket, amelyek gátolnak bizonyos citokróm P450 enzimeket, ez az oka annak, hogy az orvosok gyakran figyelmeztetik a betegeket arra, hogy ne egyenek grépfrútot a gyógyszereik beszedése előtt. A CBD, mint ahogy az kiderült, egy erősebb gátlója a citokróm P450 enzimeknek, mint a grépfrút vegyület, a bergapten (a legerősebb több grépfrút komponensek közül, amelyek gátolják a CYP-t).
Mit jelent ez a gyakorlatban például annak a betegnek, aki CBD kezelést alkalmaz egy olyan vényköteles vérhigítót (véralvadásgátló) szedése mellett, mint a warfarin? A CBD csökkenti a warfarin enzimes lebomlását, ezáltal növelve annak hatástartamát és hatását. Annak a betegnek, aki CBD olajat használ, nagy figyelmet kell szentelnie a warfarin vérszintjének változásaira és ennek megfelelően kell módosítania a dózist orvosi utasítás szerint.
Magyarországon elterjedten használt erős véralvadásgátló gyógyszer a Clexane, melynél a kölcsönhatás kockázata alacsony, tekintettel arra, hogy hatóanyaga (Enoxaparin) nem a CYP enzimeken metabolizálódik.
Egy esettanulmány szerint a rendkívül nagy dózisú CBD jelentősen megemelkedett warfarinszintekhez vezethet. Egy CBD gyógyszerrel végzett klinikai vizsgálatba bevont alany rendkívül nagy CBD-dózisokat kapott. Először átlagosan 265 mg dózist kaptott, ami enyhén emelkedett warfarinszintet eredményezett; az átlagosan 528 mg dózis esetében a warfarinszint jelentősen emelkedett; a warfarin adagjának csökkentése után az INR eredmények normalizálódtak. Általában nagyon kevés beteg szed ilyen nagy mennyiségű CBD-t.
Azonban a túlzottan magas warfarinszint súlyos következményekkel járhat. Mivel a kannabisz hatása a warfarinszintre még nem kellőképpen vizsgált, mindenképpen ajánlott megbeszélni a kezelőorvossal a CBD használatát és fokozott figyelemmel kísérni az INR eredményeket.
Egy 2009-ben közzétett esettanulmány egy tizenegy évig warfarin-terápiát folytató pácienst esetét írja le. Súlyos gasztrointesztinális vérzéssel vitték be a kórházba, amikor bevallotta, hogy a szókásosnál sokkal több kannabiszt fogyasztott; az INR értéke 10,41 volt (a terápiás tartomány általában 2 és 3 között van); a fekvőbeteg-kezelés után az INR normalizálódott; tizenöt nappal az elbocsátás után 11,55 INR-rel visszavették; miután abbahagyta a kannabisz használatát, az INR értéke 1,08 és 4,40 között maradt és nem szenvedett további komplikációkat.
Frissítés: Egy áttekintés megerősíti, hogy a CBD és a THC nem okoz gyógyszerkölcsönhatásokat minden vérhigítóval, kivéve a warfarint, amely nyilvánvalóan kényes gyógyszer, és úgy tűnik, hogy sok mindennel kölcsönhatásba lép.
A CBD-nek vérnyomáscsökkentő hatása lehet! Aki vérnyomáscsökkentő gyógygyszert szed figyeljen oda, hogy CBD-vel kombinálva a megszokott gyógyszeradag egészségtelenül alacsony vérnyomást okozhat.
A kannabisz nem befolyásolja két ismert kemoterápiás szer hatásmechanizmusát és hatékonyságát
Ezek a gyógyszerek léphetnek kölcsönhatásba a CBD-vel
Bármilyen gyógyszer, amit a citokróm P-450 enzimek bontanak le, kölcsönhatásba léphet a CBD-vel. Az Indiana Egyetem Orvosi Tanszéke szerint, ezekről a gyógyszerekről ismert, hogy a citokróm P-450 rendszert használják:
Szteroidok
HMG CoA reduktáz inhibitorok
Kalcium-csatorna blokkolók
Antihisztaminok
Prokinetikumok
HIV vírusellenes szerek
Immunszabályozók
Benzodiazepinek
Antiarrhythmiás szerek
Antibiotikumok
Érzéstelenítők
Antipszichotikumok
Antidepresszánsok
Antiepileptikumok
Béta-blokkolók
Protonpumpa-gátló
NSAID-ok (nem szteroid gyulladáscsökkentők)
Angiotenzin II blokkolók
Orális hipoglikémiás szerek
Szulfonilureák
Antidepresszánsok
Egy kutatásban a CBD minimálisan befolyásolta a szertralin, a fluoxetin és a mirtazapin metabolizmusát a sejtekben. A CBD azonban jelentősen gátolta a citalopram és az escitalopram metabolizmusát a CYP3A4 és a CYP2C19 enzimeken keresztül.
Női hormon gyógyszerek és CYP enzimek
CBD és orális fogamzásgátlók:
- A CYP1A2 szubsztrátjai: ösztradiol, etinilesztradiol
- A CYP2C9 szubsztrátjai: tesztoszteron
- A CYP2C19 szubsztrátjai: progeszteron
- A CYP2D6 szubsztrátjai: tamoxifen
- A CYP3A4 szubsztrátjai: etinil-ösztradiol, dezogesztrel, ösztradiol, progeszteron, tesztoszteron, hidrokortizon, medroksiprogeszteron, noretiszteron
- Az orális fogamzásgátlók a CYP 1A2 és a 3A4 szubsztrátjai és inhibitorai
- A szintetikus progeszteronok a CYP3A4 szubsztrátjai
- A fogamzásgátló progesztin-dezogesztrel a CYP3A4 szubsztrátja
Mivel a CBD gátolja a CYP2C9, 2C19, 3A4 enzimeket, ezért ezen hormonok szérumszintje megemelkedhet, ami fokozhatja az ezzel járó kockázatokat, például a vérrögök és a rák kialakulását.
A hormonpótló terápiát tabletták formájában alkalmazó nőknek tisztában kell lenniük annak veszélyével, hogy a CBD gátolhatja a CYP enzimeket, és erről értesíteniük kell a kezelőorvosukat.
A tamoxifen, amely szelektív ösztrogénreceptor-modulátor (SERM), a CYP2D6 és a 3A4 szubsztrátja és egy előgyógyszer, amely a lebomlás után aktiválódik. Mivel a CBD gátolhatja a CYP2D6 és a 3A4 enzimeket, a tamoxifen hosszabb ideig marad a szérumban, és a lebomlás késleltetve történik, ennélfogva kevesebb lesz a tamoxifen aktív formája, így kisebb az aktivitása és kisebb a hatékonysága.
Részletes gyűjtemény a CYP450-el kölcsönhatásba kerülő hatóanyagokról
http://medicine.iupui.edu/clinpharm/ddis/main-table/
Fontos, hogy ez a lista nem feltétlenül tartalmaz minden olyan gyógyszert, amelyet a kannabidiol (CBD) befolyásolhat. Hasonlóképpen nem minden gyógyszer, ami a felsorolt katergóriákba tartozik, okoz kölcsönhatást. Emiatt minden esetben konzultáljon egy egészségügyi szakemberrel, mielőtt bármilyen gyógyszerkombinációt választ, mivel az alternatív gyógyszerek vagy a dózis módosítása szükséges lehet. Ha aggódik, hogy a P-450 enzim rendszere nem működik megfelelően, az orvosok tesztelni tudják a rendszert, így biztosítva, hogy a szedett gyógyszerek megfelelően bomlanak le.
Ha valaki úgy dönt, hogy a szedett gyógyszerek mellett CBD olajat használ, akkor ajánlott az esetleges kölcsönhatás elkerülése vagy minimalizálása érdekében a CBD olajat NEM a gyógyszerekkel egy időben, mindig a gyógyszerek UTÁN és nem előtte, a lehető legnagyobb (akár több órás) különbséggel alkalmazni.
Rák és epilepszia
A rákkezelésben a kemoterápia pontos adagolása rendkívül fontos; az orvosok gyakran nehezen találják meg a maximális adagot, ami nem lesz katasztrofálisan mérgező. Sok kemoterápiás szer a citokróm p450 enzimrendszeren kereszül metabolizálódik. Ez azt jelenti, hogy azoknál a betegeknél, akik CBD-t használnak, azonos dózisú kemoterápia magasabb koncentrációt okozhat a vérben. Ha a CBD gátolja a kemoterápia citokróm által közvetített lebontásátt és a dózis módosítása nem történik meg, a kemoterápiás szer erősen mérgező szinten gyülemelhet fel a szervezetben.
Azonban eddig csak nagyon kevés jelentés érkezett a kannabinoid-gyógyszerkölcsönhatás mellékhatásokról a nagyszámú rákos beteg tapasztalataiból, akik azért használják a kannabiszt, hogy megbirkózzanak a kemoterápia fájdalmas mellékhatásaival. Lehetséges, hogy az egész növényi kannabisz a szinergikus hatásával képes kompenzálni a mellékhatásokat, mivel másképpen lép kölcsönhatásba, mint az izolált CBD, amit a legtöbb kutatásban alkalmaznak. Valamint, a kannabinoidok sejtvédő hatása enyhítheti a kemoterápia okozta toxicitást.
Néhány epilepsziás beteg már ütközött problémába amiatt, hogy a CBD kölcsönhatásba lép a rohamellenes gyógyszerekkel. Egy kisebb klinikai vizsgálat, amit a Massachusetts Közkórházban végeztek nehezen kezelhető epilepsziában szenvedő gyerekekkel, megállapította, hogy a CBD megemelte a klobazám nevű görcsoldó plazmaszintjét és növelte annak hosszú távú vérszintjét, és a norklobazámnak, ami ennek a gyógyszernek az aktív metabolitja. A vizsgált gyerekek legtöbbjénél csökkenteni kellett a klobazám adagját a mellékhatások miatt. Tekintettel arra, hogy a klobazámot és a CBD-t is a citokróm P450 enzimek bontják le, a gyógyszer-gyógyszer kölcsönhatás nem meglepő. A 2015. májusában megjelent tanulmány arra a következtetésre jutott, hogy “a CBD egy biztonságos és hatékony kezelés nehezen kezelhető epilepsziára [klobazámot] kapó betegeknél.” De a jelentés azt is hangsúlyozta, hogy fontos felügyelni a klobazám és norklobazám vérszintjét, azoknál a betegeknél akik CBD-t és klobazámot is használnak.
Dr. Bonni Goldstein megfigyelt eseteket, amikor kis dózisú CBD-dús és alacsony THC tartalmú kannabisz olaj koncentrátum súlyosbította a görcsökkel járó betegségeket, ahelyett, hogy elnyomta volna őket. Hogyan történhetett ez, hiszen a CBD híres epilepszia elleni tulajdonságairól?
Egy 1992-es Lester Bornheim és kollégái által végzett felülvizsgálat azt jelezte, hogy a CBD kisebb adagokban gátol bizonyos citokróm P450 enzimeket, mint ami ahhoz szükséges, hogy a CBD epilepszia elleni hatást gyakoroljon. Ez azt jelenti, hogy egy bizonyos adag CBD megváltoztathatja egy epilepszia elleni gyógyszer lebomlását, amit a beteg szed, de lehet, hogy ez a CBD mennyiség nem elég, hogy önmagában epilepszia ellenes hatást fejtsen ki. A tanácsadás amit egyes orvosok adnak ebben a helyzetben ellentmondásosnak tűnhet: Növelje a CBD adagot – talán még adjon hozzá egy kis THC-t (vagy THCA-t, a THC nyers, hevítetlen, nem-pszichotróp változatát) – és ez hatásosabb lehet a rohamok megfékezésében.
Frissítés 2023:
A kannabidiol gyógyszer-gyógyszer kölcsönhatása a szokásos kemoterápiás szerekkel
Fontos, hogy preklinikai bizonyítékok is vannak arra vonatkozóan, hogy a CBD bizonyos esetekben jelentősen csökkentheti a rákellenes gyógyszerek hatékonyságát. Ez a súlyos probléma továbbra is viszonylag feltáratlan, és néhány tanulmány váratlan eredményként említi, anélkül, hogy aktívan mechanikusan tanulmányozták volna. A közelmúltban azonban a kutatások egy mechanikus magyarázatot adtak, amikor kimutatták, hogy a CBD hatékonyan védi a rákos sejteket bizonyos fémtartalmú gyógyszerektől azáltal, hogy indukálja a metallotioneinként ismert specifikus méregtelenítő fehérjék expresszióját.
Valójában a metallotioneinok részt vesznek a sejtes védekezésben számos vegyi anyag ellen, és hatásuk nem korlátozódik a nehézfém-komplexekre. Következésképpen ez a hatás számos rákellenes gyógyszer esetében releváns lehet. Ennek megfelelően a CBD antagonista hatásait jelentették a karmusztin, a temozolomid, a ciszplatin, a karboplatin és a doxorubicin esetében. Ez arra utal, hogy a CBD egyidejű alkalmazása a rákellenes terápia során alkalmatlan lehet bizonyos gyógyszerkombinációkra, mert úgy tűnhet, hogy csökkenti a káros hatásokat, miközben valójában csökkenti a sikeres kezelés valószínűségét.
Összességében az itt összegyűjtött adatok alapján arra a következtetésre juthatunk, hogy a CBD izgalmas lehetőségeket rejt magában a rák kemoterápiás eredményeinek javításában, ha különféle standard gondozási gyógyszerekkel kombinálják, és nem csak a mellékhatások csillapítása tekintetében. Például a kialakult kezelési rezisztenciával rendelkező rákos megbetegedések esetében előnyös lehet a CBD egyidejű alkalmazása a szállítókra gyakorolt hatások miatt. Ezenkívül a karmusztint, paklitaxelt és doxorubicint tartalmazó kombinációk ígéretesnek tűnnek. Egyes adatok azonban kevésbé meggyőzőek, ellentmondó eredmények például a temozolomid és a ciszplatin esetében.
Végül a CBD karboplatinnal vagy diszulfirámmal kombinálva potenciálisan veszélyes kombinációnak tűnik (csökkenti a gyógyszer hatékonyságát). Az utolsó két példa még azt a lényeges aggodalmat is felveti, hogy a CBD által előidézett mellékhatások némelyike a rendelkezésre álló aktív gyógyszerek csökkent mennyiségét tükrözi. Így, tekintettel a klinikai adatok hiányára és csak a tervezett vagy folyamatban lévő klinikai vizsgálatokra, a jelentett ígéretes preklinikai eredményeket gondosan értékelni kell, és jelentős klinikai előnyökké kell váltani.
A teljes kutatás itt olvasható: https://www.mdpi.com/1422-0067/24/3/2885
Rejtélyes enzimek
De miért csökkenti egy epilepszia elleni gyógyszer hatását a lebontás akadályozása? Számos lehetséges válasz lehet, a szóban forgó gyógyszertől függően. Elképzelhető, hogy a gyógyszer aktív hatóanyaga (az a vegyület, amely a tényleges anti-epileptikus hatást fejti ki), az a gyógyszer bomlásterméke. Szóval, ha a CBD lelassítja az eredeti gyógyszer lebomlását, azzal kevésbé aktívvá teszi a gyógyszert.
Más magyarázatok is elképzelhetők. Például ha egyes CYP-k tevékenysége lelassul, lehet, hogy a gyógyszer egy másik metabolikus úton bomlik le, amiknek a bomlástermékei aztán befolyásolják a gyógyszer aktivitását. Vagy talán a CYP-k gátlása nem a legmeghatározóbb módja, annak ahogy a CBD kölcsönhatásba lép bizonyos epilepszia elleni gyógyszerekkel.
Hogy tovább bonyolítsuk a helyzetet, Dr. Kazuhito Watanabe a 2015-ös Nemzetközi Kannabinoid Kutató Társaság találkozóján tartott előadása Új-Skóciában, előzetes bizonyítékot hozott nyilvánosságra arrról, hogy lehetséges, hogy a CBD felerősíti néhány citokróm P450 enzim tevékenységét. Ez azt jelenti, hogy a CBD növelheti vagy csökkentheti más gyógyszerek lebomlását. Azonban ez függ a gyógyszertől és a használt adagolástól.
Bármely olyan kannabisz kezelésnek, ami a CBD terápiás lehetőségeit szeretné kihasználni, számolnia kell azzal a ténnyel, hogy a kannabidiol egyaránt inaktiválja és fokozza a különböző citokróm P450 enzimeket a májban – és ez potenciálisan gyógyszerek széles skálájára lehet hatással. A gyógyszerkölcsönhatásokra különösen fontos odafigyelni életmentő és értelem megőrző gyógyszerek, szűk terápiás indexű gyógyszerek, vagy jelentős káros mellékhatásokkal rendelkező gyógyszerek használatakor. Különösen azoknak kell ezt szem előtt tartani, akik nagy dózisú CBD koncentrátumokat vagy izolált CBD-t alkalmaznak különböző gyógyszerek használata mellett.
Áttekintés a kannabinoid-opioid interakcióról krónikus fájdalomban
CBD és ópioid kölcsönhatások:
A kannabidiol és a morfin eltérő kölcsönhatásai három nociceptív viselkedési egér modellben.
Ezek az eredmények arra utalnak, hogy különböző hatásmechanizmusok határozzák meg a CBD és a morfin közötti kölcsönhatásokat a három különböző viselkedéses vizsgálatban. A megfelelő kombinációs terápiák kiválasztása akut fájdalom kezelésére függhetnek az alapul szolgáló fájdalom típusától és körülményeitől.
http://www.ncbi.nlm.nih.gov/pubmed/25485642
Kérünk mindenkit, támogassa non-profit egysületünk munkáját, akár csak egy pohár kávé árával.
Ezen az oldalon lehet támogatást küldeni:
https://orvosikannabisz.com/tamogatas/
CBD használata opioidok mellett krónikus fájdalom csökkentésére
Szerzői jog, Project CBD. Engedély nélkül nem nyomtatható újra.
Referenciák
- Bailey DG, Malcolm J, Arnold O, Spence JD. Grapefruit juice-drug interactions. 1998. Br J Clin Pharmacol. 2004.
- Bland TM, Haining RL, Tracy TS, Callery PS. CYP2C-catalyzed delta9-tetrahydrocannabinol metabolism: kinetics, pharmacogenetics and interaction with phenytoin. Biochem Pharmacol. 2005.
- Bornheim LM, Everhart ET, Li J, Correia MA. Characterization of cannabidiol-mediated cytochrome P450 inactivation.Biochem Pharmacol. 1993.
- Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Drug-drug interaction between clobazam and cannabidiol in children with refractory epilepsy. Epilepsia. 2015.
- Jiang R, Yamaori S, Takeda S, Yamamoto I, Watanabe K. Identification of cytochrome P450 enzymes responsible for metabolism of cannabidiol by human liver microsomes. Life Sci. 2011.
- Klein C, Karanges E, Spiro A, Wong A, Spencer J, Huynh T, et al. Cannabidiol potentiates Delta(9)-tetrahydrocannabinol (THC) behavioural effects and alters THC pharmacokinetics during acute and chronic treatment in adolescent rats.Psychopharmacology. 2011.
- Stott C, White L, Wright S, Wibraham D, Guy G. A phase I, open-label, randomized, crossover study in three parallel groups to evaluate the effect of Rifampicin, Ketoconazole, and Omeprazole on the phamacokinetics of THC/CBD oromucosal spray in healthy volunteers. SpringerPlus. 2013.
- Watanabe K, Yamaori S, Funahashi T, Kimura T, Yamamoto I. Cytochrome P450 enzymes involved in the metabolism of tetrahydrocannabinols and cannabinol by human hepatic microsomes. Life Sci. 2007.
- Yamaori S, Ebisawa J, Okushima Y, Yamamoto I, Watanabe K. Potent inhibition of human cytochrome P450 3A isoforms by cannabidiol: role of phenolic hydroxyl groups in the resorcinol moiety. Life Sci. 2011.
- Yamaori S, Kinugasa Y, Takeda S, Yamamoto I, Watanabe K. Cannabidiol induces expression of human cytochrome P450 1A1 that is possibly mediated through aryl hydrocarbon receptor signaling in HepG2 cells. Life Sci. 2015.
- Yamaori S, Kushihara M, Yamamoto I, Watanabe K. Characterization of major phytocannabinoids, cannabidiol and cannabinol, as isoform-selective and potent inhibitors of human CYP1 enzymes. Biochem Pharmacol. 2010.
- Yamaori S, Okamoto Y, Yamamoto I, Watanabe K. Cannabidiol, a major phytocannabinoid, as a potent atypical inhibitor for CYP2D6. Drug Metab Dispos. 2011.
- Yamaori S, Okushima Y, Masuda K, Kushihara M, Katsu T, Narimatsu S, et al. Structural requirements for potent direct inhibition of human cytochrome P450 1A1 by cannabidiol: role of pentylresorcinol moiety. Biol Pharm Bull. 2013.
Forrás:
https://www.projectcbd.org/article/cbd-drug-interactions-role-cytochrome-p450