A kannabinoidok daganatellenes hatásai: Quo Vadis

Ez a tartalom a Fundación CANNA eredeti cikkének fordítása. Minden jog fenntartva a szerző(k) részéről.
Írta: Manuel Guzmán a Madridi Complutense Egyetemen a biokémia és molekuláris biológia professzora, a Spanyol Királyi Gyógyszerészeti Akadémia tagja, valamint a Kannabinoid Gyógyszerek Nemzetközi Szövetsége (IACM) igazgatótanácsának tagja. Kutatásai középpontjában a kannabinoidok hatásmechanizmusának és terápiás tulajdonságainak vizsgálata áll, különös tekintettel az idegrendszerre. Ez a munka több mint száz publikációt jelent nemzetközi szakfolyóiratokban, valamint számos nemzetközi szabadalmat a kannabinoidok rákellenes és neuroprotektív gyógyszerként való lehetséges terápiás alkalmazásáról. Rutinszerűen együttműködik tudományos bíráló és finanszírozó ügynökségekkel.
A kannabinoidok lehetséges daganatellenes hatása a jelenlegi orvosbiológiai kutatások egyik olyan aspektusa, amelyre a média a legtöbbet összpontosít.
Például a Cureus folyóiratban nemrég megjelent áttekintés (DOI: 10.7759/cureus.3918) feltárta, hogy a közösségi hálózatokon megjelenő hírek a kannabisz feltételezett gyógyító erejéről onkológiai betegeknél tízszer gyorsabban nőttek, mint a standard daganatellenes terápiákra hivatkozók, a számtalan alternatív daganatellenes terápia közül a kannabiszról esik a legtöbb szó (23,5%), és az esetek túlnyomó többségében a jelentések hamisak (a cikk szerzői 118 közzétett hírre egy igaz hírt becsültek).
A téma népszerűségét egyértelműen tükrözi a témában megjelent cikkek nagy száma. Így több kolléga (Guillermo Velasco, Cristina Sánchez, Mariano García de Palau, Saoirse O’Sullivan, Mike Tagen – és elnézést, ha valakit kifelejtettem), jómagammal együtt, az elmúlt éveket a kannabinoidok daganatellenes hatásáról és a mögöttes mechanizmusokról szerzett ismereteink terjesztésével töltötte.
Ebben a cikkben megpróbálom frissíteni a téma jelenlegi állapotát, a „nyers” klinikai valóságra (betegek) összpontosítva, nem pedig a gyakran „illuzórikus” preklinikai kutatásokra (egerek). Amint arra már két korábbi cikkemben rámutattam, az elmúlt évtizedek keserű tapasztalatai azt mutatják, hogy a környezetünkben a legmagasabb előfordulási és/vagy morbiditási és mortalitással járó betegségek, mint a rák, a szív- és érrendszeri megbetegedések, a neurodegeneratív megbetegedések esetén az egereken végzett számos terápiás vizsgálat a gyakorlatban sikertelen volt a betegek számára történő átültetését illetően. Igen, sajnos a kis laboratóriumi egerek patofiziológiailag sokkal egyszerűbb, robusztusabb állatok, mint mi.
Orvosi kannabisz agydaganatok kezelésére a „világ első” klinikai vizsgálatában
Már évek óta bőséges számú tudományos tanulmány gyűlt össze, amelyek azt mutatják, hogy a THC és más kannabinoidok daganatellenes hatást fejtenek ki a rák preklinikai modelljeiben, és ezt egy nagyon összetett mechanizmus révén teszik, amely a daganat típusától függően kombinációt foglal magában.
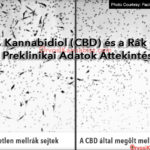
Már évek óta bőséges számú tudományos tanulmány gyűlt össze, amelyek azt mutatják, hogy a THC és más kannabinoidok daganatellenes hatást fejtenek ki a rák preklinikai modelljeiben, és ezt egy nagyon összetett mechanizmus révén teszik, amely a daganat típusától függően magában foglalja a (I) sejtproliferáció gátlás, (II) sejthalál indukálás az apoptózis folyamatával, (III) a tumoros angiogenezis gátlás és (IV) a sejtinvázió és a metasztázis gátlás legalább egy kombinációját. Bár ezek a vizsgálatok számos különböző típusú tumorsejt felhasználásával foglalkoztak, sok közülük a glioblasztóma sejtekre összpontosított. Ezenkívül a kannabinoidokkal eddig elvégzett néhány klinikai vizsgálat csak glioblasztómában szenvedő betegeket vont be. Ezért az ilyen típusú daganatokra fogok összpontosítani.
Mi az a glioblasztóma? A gliómákat hagyományosan az idegrendszer daganataiként határozzák meg, amelyek a glia (azaz idegrendszerünk neuronjait kísérő sejtek) szövettani és ultrastrukturális jellemzőit mutatják. A WHO jelenleg különféle kritériumok alapján osztályozza a gliomákat, például sejtjellemzőik (a gliasejt típusa), rosszindulatúságuk mértéke (1-től a legalacsonyabb, 4-ig, a legmagasabb) és molekuláris jellemzőik (egyik vagy másik genetikai mutáció előfordulása). Az összes glióma közül a glioblasztóma (a közelmúltig „glioblastoma multiforme” vagy „4. fokozatú asztrocitóma” néven) a leggyakoribb primer agydaganat felnőtteknél, és az egyik legagresszívabb rák (pl. a 4. fokozatú hasnyálmirigy-adenokarcinómával együtt). Ez a drámai viselkedés a glioblasztómák részéről főként a nagy proliferációs és inváziós képességüknek, a többszörös onkogén mutációk nagyon magas felhalmozódásának, valamint a kemo- és sugárterápia daganatellenes hatásaitól való elképesztő képességüknek köszönhető.
Orvosi kannabisz és rákos megbetegekdések: Kutatások itt.
Manapság a glioblasztóma első vonalbeli kezelése, amelyet „Stupp-protokollként” ismernek, három egymást követő szakaszból áll: (I) a lézió maximális sebészi eltávolítása; (II) kemo-sugárterápia temozolomid daganatellenes gyógyszerrel (75 mg/m2/nap a sugárkezelés időtartama alatt); (III) adjuváns kemoterápia magával a temozolomiddal (6 ciklus 150-200 mg/m2/nap 28 napból 5-ben). Sajnos ez a kezelési rend nagyon csekély hatással van a betegség lefolyására. Így az átlagos teljes túlélés a daganat diagnózisától és az ezzel a protokollal végzett kezelés után 12-16 hónap. A Stupp protokoll szerinti első vonalbeli kezelést követő progresszió vagy kiújulás szokásos esetben a teljes túlélés 3-9 hónap. Több tucat klinikai vizsgálatot végeztek különböző kemoterápiás szerekkel, valamint immunológiai vagy génterápiákkal a Stupp-protokoll javítása érdekében, de a sikerek nagyon marginálisak voltak. Ezért feltétlenül szükséges új terápiás beavatkozások kidolgozása a glioblasztómás betegek kezelésének javítására.
Az elmúlt néhány évtizedben a daganatellenes terápiák központi fókusza a nem specifikus kemo- és sugárterápiáktól a „személyre szabott” és molekulárisan célzott beavatkozásokig fejlődött. A kannabinoidokkal összefüggésben, amint azt fentebb is felidéztük, egy meghatározott molekuláris célpont (a kannabinoid CB1 és CB2 receptorok) aktiválása szelektív vegyületcsaláddal (THC és ezen receptorok egyéb agonistái) hatékonyan és biztonságosan gátolja a glioblasztóma sejtek növekedését egér- és patkánymodellekben meglehetősen jól ismert hatásmechanizmusok révén. A preklinikai bizonyítékok azt is jelzik, hogy a THC fokozza a temozolomid és a sugárterápia terápiás hatékonyságát egerekben. Ezenkívül bármely daganatellenes terápia egyik legkívánatosabb tulajdonsága a rosszindulatú sejteken kifejtett szelektív hatása. Ebben a tekintetben a THC indukálja a glioblasztóma sejtek apoptózisát anélkül, hogy jelentősen befolyásolná a normál, nem rosszindulatú sejtek túlélését.
A kannabinoidok daganatellenes aktivitásával kapcsolatos ismereteinkben azonban még mindig vannak jelentős hiányosságok, amelyek jövőbeli preklinikai kutatást igényelnek a klinikára fordítható terápiák optimalizálása érdekében. Például (I) bővítenünk kell a kannabinoidok daganatellenes hatásának molekuláris mechanizmusainak megértését; (II) meghatározza az endokannabinoid rendszer pontos szerepét a daganatok kialakulásában, növekedésében és progressziójában; (III) kísérleti kannabinoid alapú terápiák tervezése, amelyek a legnagyobb hatékonyságot és biztonságot nyújtják a glioblasztóma (és más rákos megbetegedések) kezelésére; és (IV) molekuláris markerek azonosítása a potenciális kannabinoidokkal végzett daganatellenes terápiákra adott válasz előrejelzésére.
Eddig három kis klinikai vizsgálatot végeztek glioblasztómás betegeken a kannabinoidok lehetséges daganatellenes hatásának értékelésére. Egy Spanyolországban lefolytatott 1a fázisú kísérleti vizsgálatban (2006-ban a British Journal of Cancer-ben jelent meg; DOI: 10.1038/sj.bjc.6603236) 9 kiújult glioblasztómában szenvedő beteget kezeltek intrakraniálisan THC-vel. Bár nem lehetett statisztikailag releváns következtetéseket levonni, a kohorsz kis mérete miatt a kezelés biztonságosnak bizonyult, és egyes betegek úgy tűnt, hogy reagáltak rá az alacsonyabb tumornövekedési ráta (agyi képalkotó technikákkal meghatározva), és a rosszindulatú markerek alacsonyabb expressziója tekintetében a tumormintákban.
Ezt követően a brit GW Pharmaceuticals cég által szervezett randomizált, kettős vak, placebo-kontrollos fázisú 1b vizsgálatban (British Journal of Cancer 2021; DOI: 10.1038/s41416-021-01259-3) összesen 21 relapszusos glioblasztómában szenvedő beteg (12 a Sativex csoportban, 9 a placebo csoportban) kapott szájnyálkahártyán keresztül Sativex gyógyszert (THC/CBD arány 1:1) standard adjuváns temozolomiddal együtt. Arra a következtetésre jutottak, hogy a Sativex biztonságossági és tolerálhatósági profilja elfogadható, és nincs nyilvánvaló lényeges gyógyszerkölcsönhatás.
Ezen túlmenően a Sativex hatásosnak tűnt a temozolomid kiegészítéseként, mivel javította a túlélési arányt 1 év alatt (83% Sativex vs. 44% placebo; p = 0,042) és 2 év után (50% Sativex vs. 22% placebo; p = 0,134).
Végül egy randomizált, kettős vak, 2. fázisú, Ausztráliában végzett kísérletben (Frontiers in Oncology 2021; DOI: 10.3389/fonc.2021.649555) két standardizált kannabisz olajat (THC/CBD arány 1:1 vagy 4:1) alkalmaztak orálisan összesen 88 betegnél (45 az 1:1 arányú csoportban, akik közül 29 fejezte be a vizsgálatot; 43 a 4:1 arányú csoportban, akik közül 32 fejezte be a vizsgálatot), akiknél relapszusos vagy inoperábilis, magas fokozatú gliomákkal. Megfigyelték, hogy az 1:1 arányú olaj (de a 4:1 arányú olaj nem) javított néhány életminőségi paraméteren, például a fizikai (p = 0,025) és a funkcionális (p = 0,014) kapacitáson, valamint az alvásindukción (p) = 0,009), anélkül, hogy jelentős káros hatásokat váltana ki. Azonban nem figyeltek meg kedvező hatást a tumor progressziójára, összehasonlító csoportként retrospektív esetcsoportot használva.
Röviden, ha ezt a három eddig elvégzett klinikai vizsgálatot optimista fényben nézzük, úgy tűnik, hogy igen, „ahol füst van, ott tűz is van”. Nyilvánvaló azonban, hogy ebben a témában komolyabb klinikai vizsgálatokra van szükség. Ebben a tekintetben azt reméljük, hogy az elkövetkező évek legalább két klinikai vizsgálat értékes adatokkal szolgálnak majd számunkra: (I) egy 2. fázisú nyílt elrendezésű vizsgálat Spanyolországban, amely egy orális THC/CBD készítmény (1:1 arányú) hatását értékeli első vonalban (vagyis műtét után és egyidejűleg standard temozolomid alapú kemoradioterápia) 30 újonnan diagnosztizált glioblasztómában szenvedő betegnél (https://clinicaltrials.gov/ct2/show/NCT03529448); és (II) egy randomizált, kettős-vak, placebo-kontrollos, 2. fázisú vizsgálat, amelyet az Egyesült Királyságban szervezett a The Brain Tumor Charity és a GW Pharmaceuticals, amely a Sativex és a standard adjuváns temozolomid együttes hatását vizsgálja 230 kiújult glioblasztómában szenvedő betegnél (https://www.thebraintumourcharity.org/media-centre/news/research-news/phase-2-trial-cannabis-based-drug-glioblastomas/).
Remélhetőleg ezek (és ideális esetben más) robusztus és jól megtervezett kísérletek egyszer és mindenkorra tisztázzák, hogy a kannabinoidok valóban beépíthetők-e a glioblasztóma kezelésére ma rendelkezésre álló, nagyon korlátozott farmakológiai arzenálba. Ha igen, akkor valószínű, hogy ez megnyithatja az ajtót más típusú rákos megbetegedések klinikai vizsgálatai előtt.
Kérünk mindenkit, támogassa non-profit egysületünk munkáját, akár csak egy pohár kávé árával.
Ezen az oldalon lehet támogatást küldeni:
https://orvosikannabisz.com/tamogatas/
Új kannabinoid készítmény glioblasztóma agydaganat kezelésére
Forrás:
https://www.fundacion-canna.es/en/antitumour-effects-cannabinoids-quo-vadis